Técnicas de iluminación
En esta página
4.2. Técnicas de iluminación#
4.2.1. Introducción#
Como se vio anteriormente, existen diferentes Tipos de microscopio, y este documento se centra en aquellos llamados compuestos. Cabe hacer también la aclaración de que existen diferentes técnicas de iluminación para utilizar en un microscopio compuesto. Técnicas tales como el campo oscuro, la iluminación oblicua, o la Rheinberg, por sólo mencionar algunas de las muchas disponibles.
¿Por qué tantas técnicas? Porque dependiendo de la muestra es más factible utilizar una técnica de iluminación u otra, y así poder obtener una mayor información de lo que se ve. Por ejemplo, para apreciar mejor a los espermatozoides en una espermatobioscopía, la Organización Mundial de la Salud recomienda el empleo de la técnica de contraste de fases en su manual «WHO Laboratory Manual for the Examination and Processing of Human Semen», del cual recién ha publicado su sexta edición.
También es importante recalcar aquí la diferencia entre tipos de microscopio y técnicas de iluminación, ya que no son sinónimos, y es frecuente que las personas empleen términos como «microscopio de campo oscuro» o «microscopio de contraste de fases» para referirse —según ellas— a tipos de microscopios, cuando a lo que en realidad se refieren es a técnicas de iluminación. Si razonamos bien la diferencia, nos daremos cuenta de que esto significa que un microscopio puede ser adaptado para emplear una o más técnicas de iluminación. Para hacer uso de dichas técnicas en un microscopio que normalmente utilice campo claro, primero tenemos que informarnos bien en la técnica que querramos utilizar y, posteriormente, llevar a cabo las implementaciones necesarias para efectuarlas. Así pues —por ejemplo— veremos que para emplear la técnica de campo oscuro se necesitan condensadores especiales (Figura 4.12).

Figura 4.12 Condensadores especiales para la técnica de campo oscuro. El izquierdo es para la observación con objetivos secos o de aire, mientras que el izquierdo es para el empleo de la técnica con objetivos de aceite de inmersión.#
Con suficiente investigación, veremos que algunas técnicas son relativamente baratas de implementar, mientras que otras, en cambio, requieren de una inversión considerable por necesitar piezas muy especializadas.
En las siguientes líneas se describen algunas de las técnicas de imagen más populares —con las que es posible que alguna vez usted interactúe, si tiene acceso a un microscopio—. Esto con el fin de que aprenda a identificarlas y conozca los rudimentos de su fundamento.
4.2.2. Campo claro#

Figura 4.13 Condylostoma sp. Imagen de Raúl M. González para la 2006 Nikon’s Small World Photomicrography Competition.#
El campo claro es la técnica de iluminación que llevan a cabo por omisión la mayoría de los microscopios compuestos. Si alguna vez ha visto o utilizado algún microscopio, lo más seguro es que haya sido empleando esta técnica.
El campo claro suele ser el escogido en la mayoría de las universidades, laboratorios clínicos y hospitales, pues suele ser suficiente —salvo algunas excepciones— para llevar a cabo las observaciones que se realizan en estos lugares.
La técnica puede ser fácilmente identificable por su fondo claro —cuya tonalidad puede variar en función del tipo de luz empleada—, y funciona atravesando directamente la muestra con un haz de luz —del condesador al objetivo—, revelando a la muestra con sus colores naturales (que en muchos casos no los tienen, siendo la muestra transparente u opalescente).
En la preciosa imagen de Raúl M. González (Figura 4.13) se aprecia un protozoario. Se observa verde debido a los cloroplastos que contiene, los cuales son organelos especiales que le permiten realizar la fotosíntesis.
4.2.3. Campo oscuro#
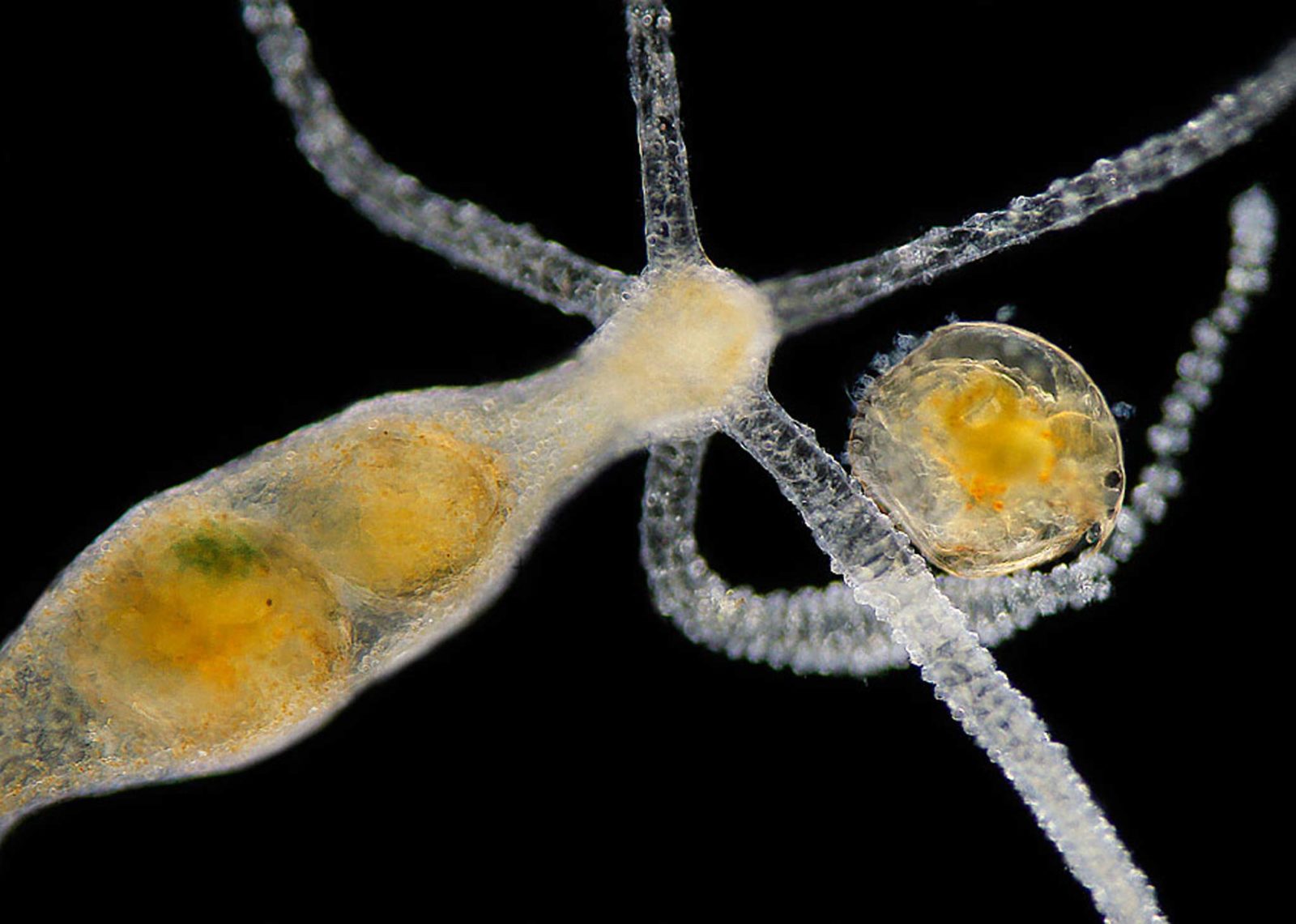
Figura 4.14 Hydra viridissima capturando a una Daphnia pulex. Imagen del Dr. Stephen Lowry para la 1986 Nikon’s Small World Photomicrography Competition.#
Con frecuencia ocurre que las muestras ha observar no tienen color —o no el suficiente—, por lo que los detalles de su estructura se pierden al emplear la técnica de campo claro. Una opción para salvar este contratiempo es el empleo de técnicas de tinción; no obstante, debido a su propia naturaleza, estas técnicas requieren de muestras no vivas para su correspondiente tinción.
¿Pero qué pasa cuando la muestra carece del color necesario para su observación y es preciso que ésta se encuentre viva? Aquí es donde entra la técnica de campo oscuro. Ésta funciona interponiendo un disco negro entre el haz de luz que parte de la fuente de iluminación y la base del condensador, antes de pasar por su diafragma. Esto hace que la luz no atraviese directamente a la muestra —como así ocurre en la técnica de campo claro—, sino que incide sobre la muestra desde su alrededor, iluminando el cuerpo de la muestra al tiempo que da el característico tono negro al fondo del campo.
El empleo del campo oscuro permite la observación de detalles que de otra forma pasarían desapercibidos en muestras vivas sin o con poco color natural, y es distinguible por el fondo negro otorga.
En la increíble fotografía del Dr. Stephen Lowry (Figura 4.14) se observa a una hidra atrapando en tiempo real a una pulga de agua. Nótese la calidad de los detalles de los tentáculos de la hidra, así como el fondo negro del campo.
4.2.4. Contraste de fases#
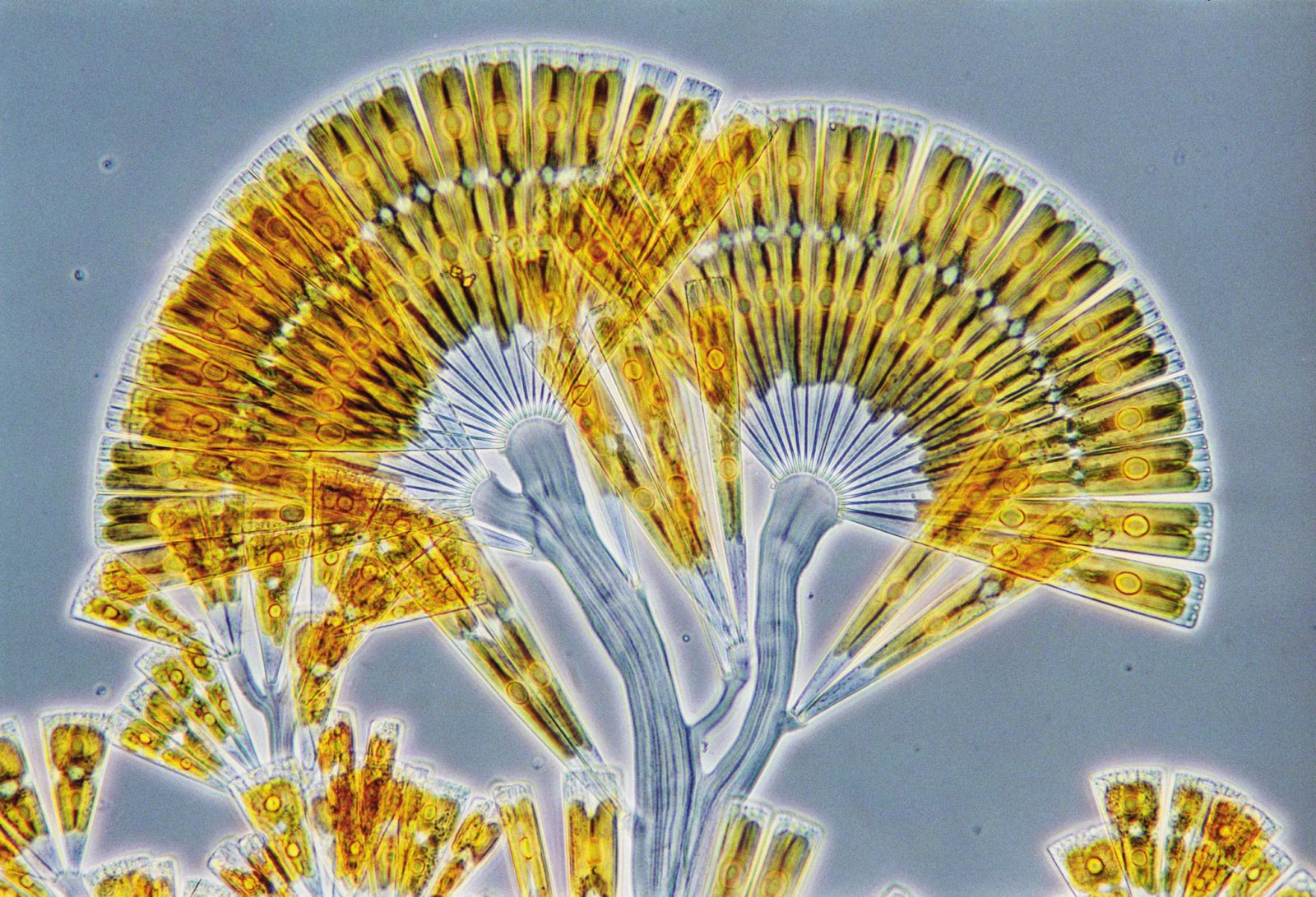
Figura 4.15 Licmophora flabellata (diatomea marina). Imagen de Wim van Egmond para la 2002 Nikon’s Small World Photomicrography Competition.#
Al igual que el campo oscuro, la técnica de contraste de fases tiene como principal objetivo la observación de muestras vivas sin teñir. Funciona transformando las variaciones de fase de luz —causadas por muestras transparentes— en cambios de amplitud de luz, las cuales pueden ser observadas sin dañar las estructuras celulares de los especímenes vivos, por lo que puede utilizarse para la observación continua.
A grandes razgos, cuando la luz atraviesa una muestra, sufre mínimos cambios en el índice de refracción, el cual varía en función de su grosor, provocando que la luz difracte y se disperse apenas un poco. El sistema que compone la ténica de contraste de fases amplía este efecto, incrementando artificialmente el contraste, consiguiendo de esta manera un nivel de detalle no alcanzable con otras técnicas.
En la magnífica imagen de Wim van Egmond (Figura 4.15) se aprecia una diatomea marina —alga que forma parte del fitoplancton y que se caracteriza por tener una pared celular basada en silicio en lugar de carbono, como en el resto de las formas de vida del planeta—. Por favor, nótese el grado de detalle logrado gracias al aumento del contraste, el cual produce —entre otras cosas— un halo alrededor de la muestra, sello característico de esta técnica.
4.2.5. Contraste de interferencia diferencial (DIC)#
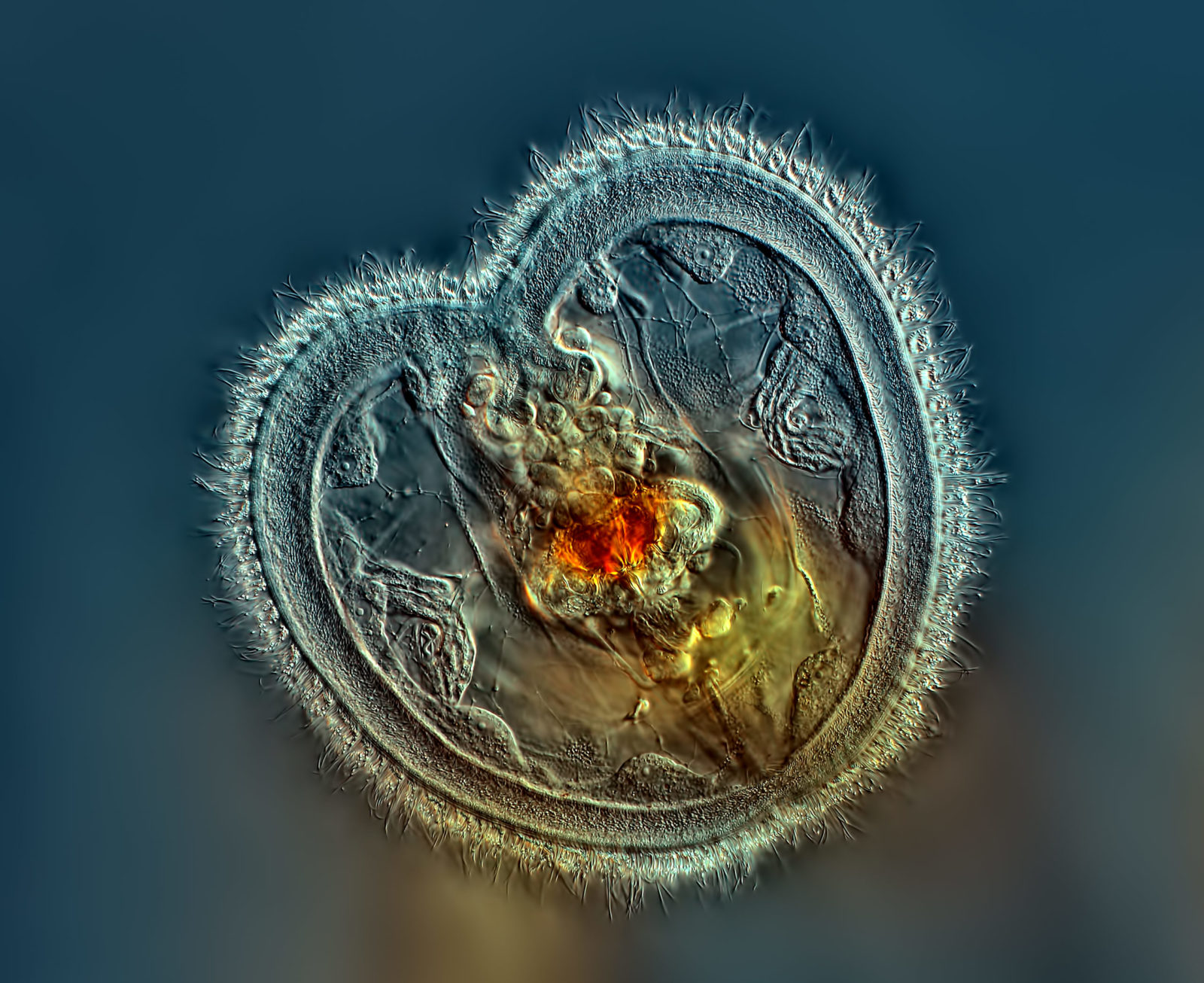
Figura 4.16 Rotífero mostrando la boca y la corona en forma de corazón. Imagen de Rogelio Moreno para la 2014 Nikon’s Small World Photomicrography Competition.#
El contraste de interferencia diferencial (DIC, por sus siglas en inglés) es otra técnica que permite la observación de especímenes vivos sin teñir. Su funcionamieno es relativamente complejo y se fundamenta en la interferometría —métodos que combinan luz proveniente de distintas fuentes para incrementar la resolución—. En pocas palabras —muy muy pocas palabras—, esta técnica funciona polarizando el haz de luz de la fuente de iluminación, para posteriormente dividirla en dos mediante un prisma. Esta luz luego atraviesa al condensador y la muestra e ingresa al objetivo. Posteriormente, estos haces son entregados a un segundo prisma, que nuevamente los une en un sólo haz. Esta luz es después enviada a un analizador que —luego de «hacer lo suyo»— la conduce a los oculares y/o la cámara fotográfica, según corresponda.
La técnica de contraste de interferencia diferencial se caracteríza por entregar imágenes de alta resolución y con buen contraste, pero sin el halo luminoso que rodea a las muestras de la técnica de contraste de fases.
En la bellísima imagen de Rogelio Moreno (Figura 4.16) se observa la boca y corona de un rotífero —pequeño animal heterótrofo que utiliza su corona para producir corrientes de agua, las cuales atraen a sus presas directamente a su boca—. Obsérvese la tremenda calidad en el detalle, lograda gracias a las estupenda resolución y contraste de esta técnica. Incluso pueden apreciarse claramente los cilios —vellocidades— de la corona.
4.2.6. Fluorescencia#
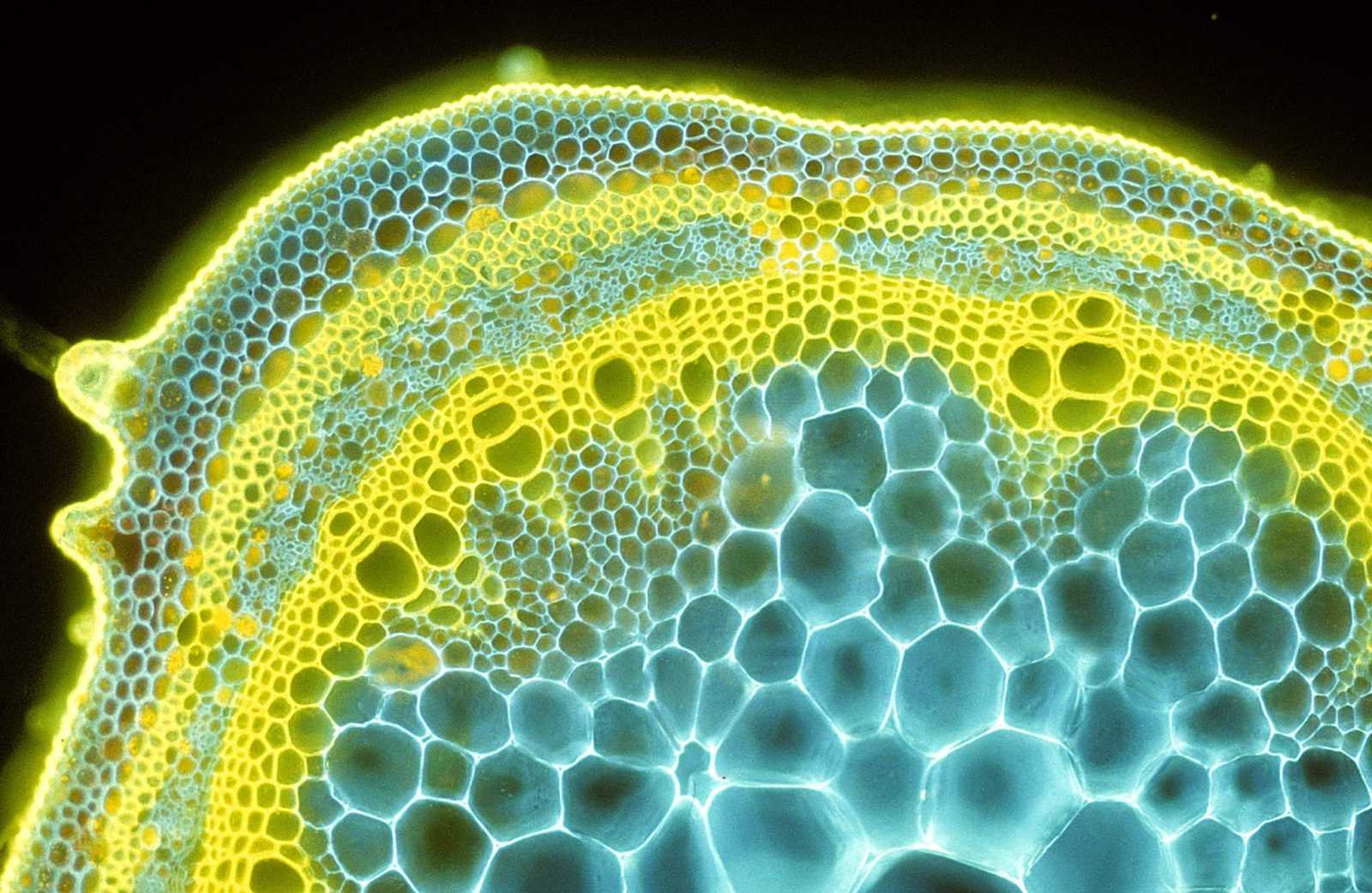
Figura 4.17 Sección transversal de un tallo de soja, teñido con dos fluorocromos para mostrar la distribución de celulosa (azul) y lignina (amarillo). Imagen de Phil Gates para la 1985 Nikon’s Small World Photomicrography Competition.#
La técnica de fluorescencia utiliza iluminación de alta intensidad para excitar moléculas fluorescentes presentes en el espécimen. Recordemos —como ya se vio en La naturaleza de la luz— que cuando un electrón absorbe energía éste se excita y salta aun nivel e energía mayor, para luego relajarse y volver a su estado basal. Como resultado de este salto de retorno, el espectro de emisión se desplaza a longitudes de onda más largas. Este es el principio de esta técnica.
La muestra se irradia con una banda deseada y específica de longitudes de onda y luego se separa la fluorescencia emitida de la luz de excitación. Sólo la luz de emisión alcanza el ojo del observador para que las estructuras fluorescentes resultantes se superpongan con alto contraste sobre un fondo muy oscuro, o negro.
La fluorescencia se emplea fundamentalmente en el ramo de la biología, donde se le utiliza para determinar la distribución de una sola especie de molécula, así como su cantidad y ubicación dentro de una célula.
En la preciosa fotografía de Phil Gates (Figura 4.17) se observa una sección transversal de un tallo de soja, pudiéndose discriminar, mediante esta técnica, la distribución de la celulosa —polisacárido estructural de las plantas— y la lignina —polímero fenólico reticulado que forma parte de la estructura de los tejidos de soporte en plantas—. Preste especial atención al fondo oscuro y al vívido color de la muestra, que incluso parece desprender un bello halo cromático. Ambas características son la firma visual de esta técnica.
4.2.7. Iluminación Köhler#
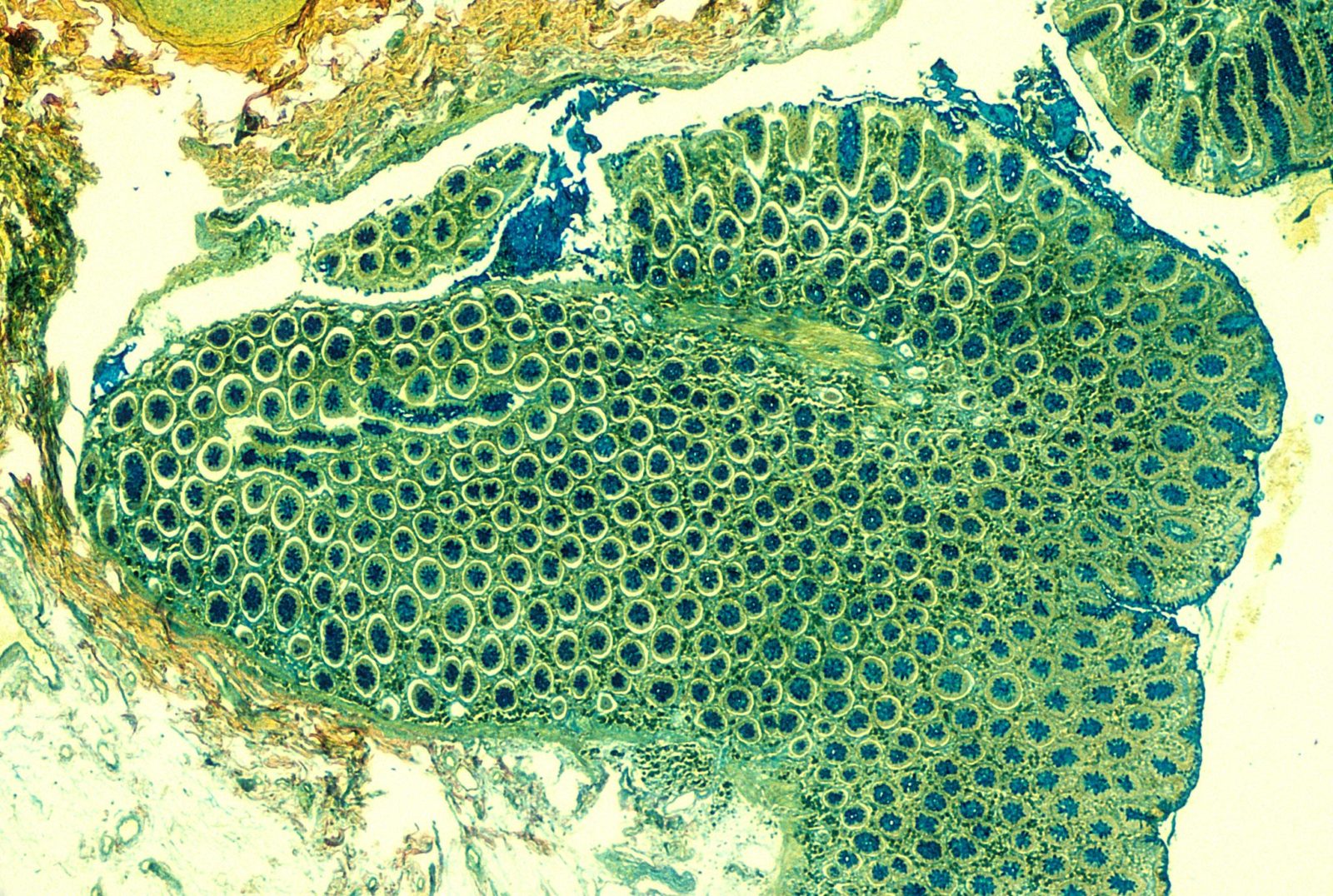
Figura 4.18 Tejido de colon con tinción histológica de mucopolisacáridos. Imagen de Paul Kolsanoff para la 1977 Nikon’s Small World Photomicrography Competition.#
Inicialmente, los mecanismos de iluminación de los microscopios sólo permitían iluminar una parte del campo de observación y no la totalidad de éste. Y esto constituía un problema, especialmente a la hora de documentar la muestra mediante fotografía. Con esto en mente, el Dr. August Karl Johann Valentin Köhler, trabajador de Carl Zeiss Ag —uno de los titanes en la fabricación de lentes de la más alta calidad y de optoelectrónicos, incluidos los microscopios—, desarrolló una nueva técnica que permite la iluminación uniforme del campo.
La invención revolucionaria de Köhler implicó grandes mejoras en la microscopía y en otras técnicas que se valen de ella como base, como la de campo oscuro.
Prácticamente la totalidad de los microscopios de gama alta —y algunos de la media— hacen uso de este importante avance.
En la interesante imagen de Paul Kolsanoff (Figura 4.18) puede observarse —de forma clara y uniformemente iluminado— tejido de colon previamente tratado con tinción histológica. La iluminación homogénea en la totalidad del campo de observación es la firma de esta técnica.
4.2.8. Iluminación oblicua#

Figura 4.19 Cristal de sal de mesa. Imagen de Saulius Gugis para la 2021 Nikon’s Small World Photomicrography Competition.#
La iluminación oblicua tiene un fundamente sencillo: consiste en iluminar la muestra desde los lados, en ángulos inclinados, en lugar de hacerlo de forma directa, como así ocurre en la técnica de campo claro.
No obstante su simpleza, esta técnica tiene la capacidad de revelar detalles con un elevado contraste, dando a la imagen del espécimen un relieve hermoso y característico.
En la fotografía de Saulius Gugis (Figura 4.19) tenemos un simple cristal de sal de mesa —cloruro de sodio— que, a través de la iluminación oblicua, revela complejos e interesantes detalles.
4.2.9. Iluminación Rheinberg#

Figura 4.20 Pluma de pájaro cardenal dominicano. Imagen de Ian Walker para la 2005 Nikon’s Small World Photomicrography Competition.#
La técnica de iluminación Rheinberg es realmente una variante de la de campo oscuro. En lugar de interponer un disco negro entre la fuente de iluminación y la base del condensador —como sucede en el campo oscuro— se coloca uno de color (o de varios colores, según el efecto que se busque). Esto hace que la luz se coloree y, por consiguiente, ilumine a la muestra con ricos y nutridos colores.
En la bonita imagen de Ian Walker (Figura 4.20) se ve una pluma de pájaro bellamente coloreada por acción y efecto de esta técnica. La presencia de una muestra llena de color —pero sobre todo, de un fondo con uno o varios vívidos colores— es la marca inconfundible de la iluminación Rheinberg.
4.2.10. Luz polarizada#

Figura 4.21 Aminoácidos cristalizados de L-glutamina y \({\beta}\)-alanina. Imagen de Justin Zoll para la 2019 Nikon’s Small World Photomicrography Competition.#
La técnica de luz polarizada emplea dos filtros polarizadores —uno entre el condensador y la muestra (polarizador), y otro entre la muestra y el observador (analizador)—. Cuando el haz de luz pasa a través de un espécimen con propiedad birrefringente, se refracta y se divide en dos, y uno de ellos se gira 90°. Estos rayos de luz refractados viajan al analizador, que los deja pasar si éste se encuentra alineado correctamente —a 90°—. Por tal motivo, únicamente los materiales birrefringentes producen imagen en esta técnica.
La luz polarizada tiene su principal empleo en el ámbito de la petrografía; no obstante, también tiene su uso en aplicaciones biológicas, ya que algunas células y sustancias biológicas contienen materiales que pueden interactuar con luz polarizada.
En la peculiar imagen de Justin Zoll (Figura 4.21) se tienen aminoácidos cristalizados de ciertas proteínas —L-glutamina y \({\beta}\)-alanina—. Por favor, tenga a bien en reparar en la presencia de múltiples colores con degradados policromáticos. Este es el sello de distinción de esta técnica.
4.2.11. Otras técnicas#

Figura 4.22 Sección de la cabeza de una mariquita naranja (Halyzia sedecimguttata). Imagen de Geir Drange para la 2016 Nikon’s Small World Photomicrography Competition.#
Además de las aquí brevemente expuestas, existen otras técnicas de iluminación, cada una de ellas con sus peculiaridades, sus ventajas y desventajas. Algunas son incluso aplicables a ciertos tipos de microscopio, distintos al compuesto; como la técnica de luz reflejada, que encuentra su máximo potencial en microscopios estereoscópicos.
En la preciosa y tierna imagen de Geir Drange (Figura 4.22) se observa la sección de la cabeza de un pequeño coleóptero, una mariquita naranja, empleando la técnica de luz reflejada.
Si usted tiene un acceso total o relativamente libre a un microscopio, le invito a jugar y experimentar con la emoción y curiosidad propias de un niño. Pruebe con distintas técnicas, filtros y procedimientos, y maraville su mente con la belleza de la física y la microscopía.
